

Institut für
OL Ökologischen Landbau
Projekt
Mikropilz gegen Wurmlarven
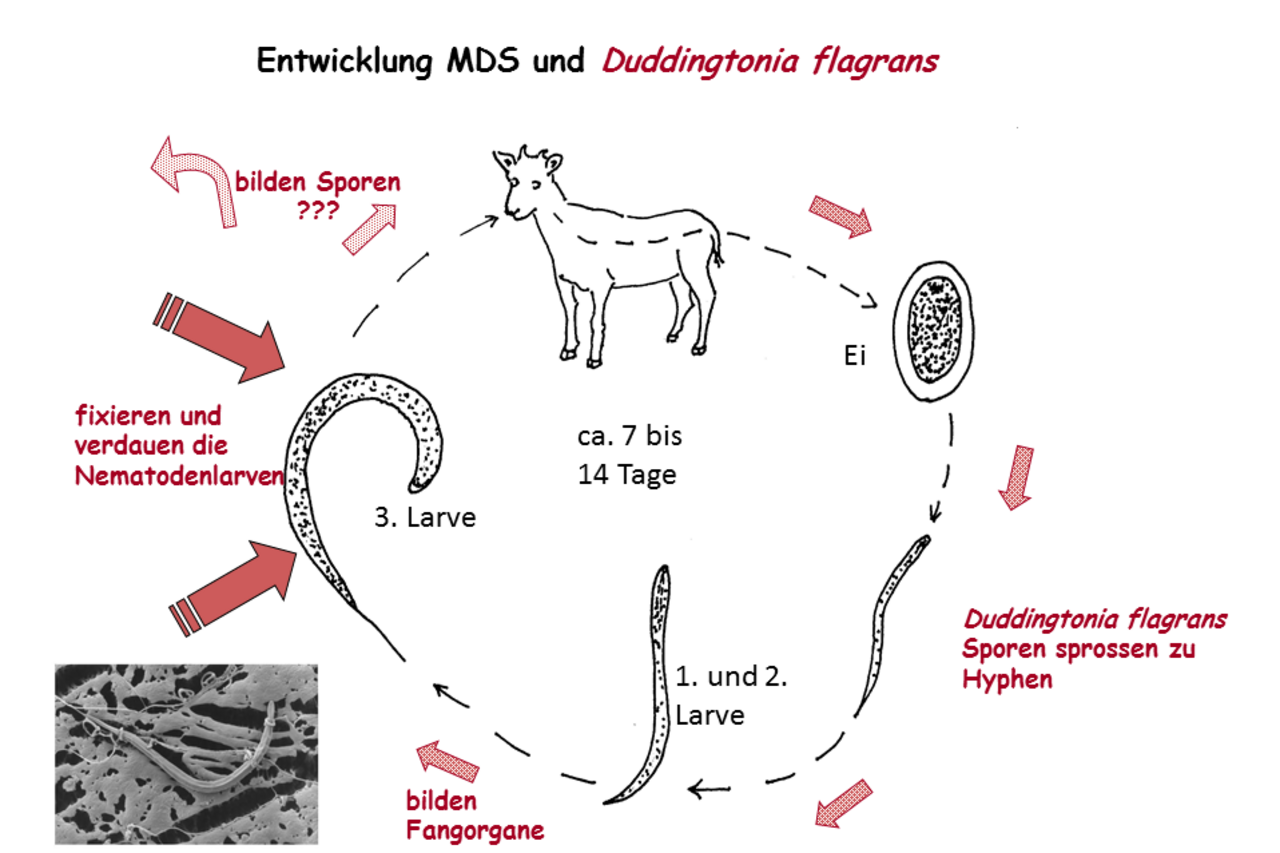
Biologische Kontrolle der Magen-Darm-Strongyliden bei kleinen Wiederkäuern mithilfe des nematophagen Pilzes Duddingtonia flagrans
Die Weidehaltung von Schaf und Ziege wird durch Magen-Darm-Strongyliden gefährdet. Gegen Entwurmungsmittel sind viele Würmer resistent geworden. Wenn schon die Wurmlarven auf der Weide kurz gehalten werden, reduziert das den Infektionsdruck auf die Nutztiere.
Hintergrund und Zielsetzung
Wegen der Bedrohung durch klinische und subklinische Parasitenerkrankungen, ist es problematisch Kleinwiederkäuer zu weiden. Die wirtschaftlichen Verluste infolge verminderter Zunahmen und verringerter Milch- und Wollproduktion sind eingehend in der Literatur beschrieben. Angesichts fortgeschrittener Resistenz gegen die üblichen Entwurmungsmittel werden auch andere Möglichkeiten zur Parasitenkontrolle stärker beachtet. In der ökologischen Landwirtschaft sind Alternativen zur chemischen Behandlung grundsätzlich erwünscht. So ließen sich etwa Nematoden biologisch bekämpfen, indem ihre natürlichen Feinde gefördert werden. Seit Ende der dreißiger Jahre des vorigen Jahrhunderts ist das Prinzip bekannt.
Vor einigen Jahren wurde dieser Ansatz für parasitische Nematoden im Nutztier wiederaufgenommen. Als geeigneter Kandidat hat sich der nematophage Mikropilz Duddingtonia flagrans herausgestellt, weil seine Sporen nicht resorbiert werden und die Magen-Darm-Passage im Tier mit guter Keimfähigkeit überstehen. Durch das tägliche Zufüttern einer bestimmten Sporenmenge können bei jedem Kotabsatz Sporen mit ausgeschieden werden. Die im Kothaufen aus den Parasiteneiern schlüpfenden Larven werden von den sich zeitgleich entwickelnden Raubpilzen reduziert. Damit wird der Infektionsdruck auf der Weide verringert. In vitro Versuche und Feldstudien an Rindern in den neunziger Jahren erzielten sehr gute Ergebnisse. Daraufhin entwickelte das Unternehmen Chr. Hansen aus Dänemark ein patentiertes Verfahren zur Herstellung des Sporenmaterials. Über den Einsatz von Duddingtonia flagrans bei kleinen Wiederkäuern sind bisher wenige Untersuchungen durchgeführt worden. Wir wollen die Frage klären, ob das genannte Verfahren für die Ziegen- und Schafhaltung empfehlenswert ist.
Vorgehensweise
Mit dem Weideaustrieb 2002 haben wir 20 erst- und zweitsömmrigen, natürlich infizierten weiblichen Ziegen (Bunte Deutsche Edelziege) und 20 ebensolchen Schafen (Ostfriesisches Milchschaf, var. schwarz) 3 Monate lang täglich 0,5 Millionen Sporen von D. flagrans pro kg Körpergewicht, untergemischt in eine kleine Kraftfutterration (100g/Tier/Tag), zugefüttert. Chr. Hansen Ltd., Horsholm, Dänemark lieferte das Sporenmaterial. Es wurde in langen Trögen gefüttert, so dass jedes Tier einen Fressplatz hatte. Die beiden genauso zusammengesetzten Kontrollgruppen erhielten die Kraftfutterration ohne Sporenmaterial. Alle vier Gruppen hatten ihre eigene, gleichwertige Standweide (1,4 ha/Gruppe).
Alle 14 Tage bis zum Aufstallen im Oktober haben wir beim Einzeltier das Körpergewicht und die Anzahl von Wurmeiern pro Gramm Kot (EPG) ermittelt. An vier Terminen wurden Blutproben gezogen, um das Serumpepsinogen zu bestimmen. Zusätzlich wurden alle 14 Tage die Larven aus Kotkulturen und ausgewaschenen Weidegrasproben (2 pro Weide) bestimmt. In der Mitte und am Ende der Weidesaison setzten wir je Gruppe 2 Tracerlämmer, die noch keinen Kontakt zu Magen-Darm-Würmern hatten, hinzu. Nach 3 Wochen Weidezeit und anschließender dreiwöchiger Stallzeit wurden diese Tiere geschlachtet, seziert und ihre Wurmbürde bestimmt.
Im Jahr 2003 haben wir versucht, bei 45 melkenden Ziegen durch die Zufütterung des nematophagen Pilzes Duddingtonia flagrans Einfluss auf die Eiausscheidung zu nehmen, um so gegebenenfalls eine Entwurmung einzusparen. Es wurden 6 Wochen lang täglich 1,2 Millionen Sporen/kg Körpergewicht und anschließend weitere 6 Wochen lang 0,25 Millionen Sporen/kg Körpergewicht zugefüttert.
Daten und Methoden
Eizahlbestimmung nach McMaster mit einer Sensitivität von 33 Eiern pro Gramm Frischkot.
Körpergewicht: Elektronische Viehwaage, ± 0,1 kg Kotkulturen (jeweils 3-5 Tiere gepoolt) zur Mengenbestimmung der Larven und deren Differenzierung nach Roberts und O'Sullivan.
Larvenbestimmung aus Weidegrasproben nach Sievers-Prekehr.
Serumpepsinogen : Tyrosin photometrisch bestimmt nach Berghen.
Tracer: Nach Ausspülung folgte die Untersuchung von 10% Aliquot über ein Sieb mit 100 µm Maschenweite.
Differenzierung nach Barth und Visser.
Statistik: Excel (C) Microsoft
Ergebnisse
Im Jahr 2002 hatten die Ziegen der Kontrollgruppe nach drei Monaten nur an zwei Untersuchungsterminen signifikant höhere mittlere Eiausscheidungszahlen als die der Versuchsgruppe. Bei den Schafen gab es keine signifikanten Unterschiede. Maximal wurde die Larvenanzahl in Kotkulturen um 81,3 % bei den Schafen und um 67,9 % bei den Ziegen reduziert (nicht signifikant). Die Differenzierung zeigte, dass alle erwartbaren Wurmarten vorhanden waren und die Zufütterung von D.flagrans - Sporen keinen erkennbaren Einfluss auf die Artenverteilung hatte. In den Kontrollgruppen mussten erkrankte Einzeltiere häufiger anthelminthisch behandelt werden, als in den Versuchsgruppen (nicht signifikant).
Zum Ende der Weidesaison war der Körpergewichtszuwachs bei den Versuchsziegen um 1,7 kg und bei den Versuchsschafen um 0,7 kg höher als in den Kontrollgruppen (nicht signifikant). Nur die Untergruppe der erstsömmrigen Ziegen erreichte signifikante Körpergewichtsunterschiede (p<0,05). Keine signifikanten Unterschiede ergaben sich bei den Weidegraslarven. Die Auswertung der Ergebnisse der Tracer zeigte, dass beide Gruppen, die am 1.8. auf die Weide gebracht wurden, erheblich höhere Anzahl von pathogenen Würmern (Hämonchus contortus, Teladorsagia circumcincta) beherbergten als die Tracer, die am 25.9. eingesetzt wurden. Die frühen Tracer waren auch klinisch stärker betroffen. Unterschiede zwischen Versuchs- und Kontrollgruppe konnten wegen der geringen Anzahl (n = 2) nicht bestimmt werden.
Die Pepsinogenwerte als Ausdruck einer Labmagenschädigung durch die Würmer stiegen bis Ende August an. Nur zu diesem Zeitpunkt war der Unterschied bei den Ziegen signifikant (p<0,05).
Die Witterungsbedingungen (extremer Regenfall) könnten die insgesamt enttäuschenden Resultate beeinflusst haben und damit gezeigt haben, wie empfindlich diese Methode gegen solche Parameter zu sein scheint.
Im Jahr 2003 konnten wir durch Zufüttern der Sporen nicht verhindern, dass die Eiausscheidung im Verlauf der Weideperiode stark anstieg und die Weide entsprechend hoch kontaminiert wurde. Wir konnten eine Entwurmung im Sommer (während der Laktation!) nicht vermeiden.
Andere Forschergruppen hatten bei Schafen ähnlich enttäuschende Ergebnisse. Ein EU-Antrag der Firma Chr.Hansen, D.flagrans-Sporen als Fütterungszusatzstoff zuzulassen, wurde abgelehnt; die Firma hat die Produktion der Sporen daraufhin eingestellt. Deshalb sind weitere Versuche nicht geplant.
Links und Downloads
Dissertation von C. Holst (2005, Tierärztliche Hochschule Hannover).
Beteiligte externe Thünen-Partner
-
Stiftung Tierärztliche Hochschule Hannover
(Hannover, Deutschland)
Zeitraum
9.2001 - 9.2004
Weitere Projektdaten
Projektstatus:
abgeschlossen
Publikationen
- 0
Malama E, Hoffmann-Köhler P, Biedermann I, Koopmann R, Krücken J, Manuel JM, Marinez Moreno A, Samson-Himmelstjerna G von, Sotiraki S, Demeler J (2014) Development of a milk and serum ELISA test for the detection of Teladorsagia circumcincta antibodies in goats using experimentally and naturally infected animals. Parasitol Res 113(10):3651-3660, DOI:10.1007/s00436-014-4030-6
- 1
Koopmann R, Dämmrich M, Ploeger H (2013) Entscheidungsbaum zur vorausschauenden Bekämpfung von Magen-Darm Würmern bei Wiederkäuern. In: Neuhoff D, Stumm C, Ziegler S, Rahmann G, Hamm U, Köpke U (eds) Beiträge zur 12. Wissenschaftstagung Ökologischer Landbau : Ideal und Wirklichkeit: Perspektiven ökologischer Landbewirtschaftung . Berlin: Köster, pp 474-475
- 2
Biedermann I, Koopmann R, Samson-Himmelstjerna G von, Demeler J (2011) Entwicklung eines Serum- und Milch-ELISAs zum Nachweis der Infektion mit Magen-Darm-Strongyliden bei Ziegen. In: Leithold G, Becker K, Brock C (eds) Beiträge zur 11. Wissenschaftstagung Ökologischer Landbau : Es geht ums Ganze: Forschen im Dialog von Wissenschaft und Praxis : Bd. 2, Tierproduktion und Sozioökonomie. Berlin: Köster, pp 232-233
- 3
Koopmann R (2010) Wie würde sich die Wurmbelastung der Weide verändern, wenn lediglich ein Teil der Ziegen- oder Schafherde entwurmt wird? Landbauforsch SH 335:21-30
- 4
Epe C, Holst C, Koopmann R, Schnieder T, Larsen M, Samson-Himmelstjerna G von (2009) Experiences with Duddingtia flagrans administration to parasitized small ruminants. Veterinary Parasitol 159(1-2):86-90
- 5
Rahmann G (2009) Ökologische Schaf- und Ziegenhaltung : 100 Fragen und Antworten für die Praxis. 2., überarb. Aufl. Braunschweig: FAL, 261 p
- 6
Rahmann G, Koopmann R, Seip H (2008) Alternative strategies to prevent and control endoparasite diseases in goat farming. In: Proceedings of the 9th International Conference on Goats : "Sustainable Goat Production: Challenges and Opportunities of Small and Large Enterprises" ; Querétaro, México, August 31st - September 4th, 2008. p 266
- 7
Epe C, Holst C, Koopmann R, Schnieder T, Larsen M, Samson-Himmelstjerna G von (2008) Investigation on the influence of nematophagous fungi as feed additive on nematode infection risk of sheep and goats on pasture. Landbauforsch 58(3):191-202
https://literatur.thuenen.de/digbib_extern/bitv/dk040432.pdf
- 8
Rahmann G, Seip H (2007) Alternative management strategies to prevent and control endo-parasite diseases in sheep and goat farming systems - a review of the recent scientific knowledge. Landbauforsch Völkenrode 57(2):193-206
https://literatur.thuenen.de/digbib_extern/bitv/dk038232.pdf
- 9
Rahmann G, Seip H (2007) Bioactive forage and phytotherapy to cure and control endo-parasite diseases in sheep and goat farming systems - a review of current scientific knowledge. Landbauforsch Völkenrode 57(3):285-295
https://literatur.thuenen.de/digbib_extern/bitv/dk038397.pdf
- 10
Koopmann R, Epe C (2007) Der Mikropilz Duddingtonia flagrans zur biologischen Bekämpfung von Magen-Darm-Nematoden der Nutztiere - Übersicht zu Feldstudien 1994-2006. In: Zikeli S, Claupein W, Dabbert S (eds) Beiträge zur 9. Wissenschaftstagung Ökologischer Landbau "Zwischen Tradition und Globalisierung" : Universität Hohenheim, 20.-23. März 2007 ; Bd. 2. Berlin: Köster, pp 673-676
- 11
Barth K, Koopmann R (2005) Endoparasiten und Milchqualität bei Ziegen im Ökologischen Landbau. In: Heß J, Rahmann G (eds) Beiträge zur 8. Wissenschaftstagung Ökologischer Landbau "Ende der Nische" : Kassel, 1.-4. März 2005. Kassel: Kassel University Press, pp 407-408
- 12
Koopmann R (2005) Neue Empfehlungen für die Behandlung bei Wiederkäuern : Resistente Magen-Darm-Würmer. Ökologie & Landbau 33(136):24-26
- 13
Barth K, Koopmann R (2004) Parasitenbelastung und Milchqualität bei Schafen und Ziegen im ökologischen Landbau. In: Bundesforschungsanstalt für Landwirtschaft (ed) Ressortforschung für den ökologischen Landbau 2004 : Statusseminar 2004 ; 5. März 2004 Biologische Bundesanstalt für Land- und Forstwirtschaft (BBA), Kleinmachnow ; Tagungsreader. pp 28-29
- 14
Koopmann R, Barth K (2004) The relationship between worm burden and milk quality in goats. In: Hovi M, Sundrum A (eds) Organic livestock farming : potential and limitations of husbandry practice to secure animal health and welfare and food quality : proceedings of the 2nd SAFO Workshop 25-27 March 2004, Witzenhausen, Germany. Reading: Univ, pp 77-86
- 15
Koopmann R, Epe C (2003) Anthelmintika-Resistenz in der ökologischen Schafhaltung. Jahresber Bundesforschungsanst Landwirtsch Braunschweig Völkenrode 2002:164-165
- 16
Koopmann R, Barth K, Holst C, Epe C, Samson-Himmelstjerna G von, Larsen M (2003) Biologische Kontrolle der Magen-Darm-Strongyliden bei Milchschafen und Milchziegen auf der Weide mittels Duddingtonia flagrans. Jahresber Bundesforschungsanst Landwirtsch Braunschweig Völkenrode 2002:161
- 17
Koopmann R, Holst C (2003) Die "FAMACHA(TM) Eye-Colour-Chart" in einer Feldstudie mit Schafen und Ziegen in Norddeutschland. Tierärztl Praxis G 31:68
- 18
Koopmann R, Holst C (2003) On-farm Untersuchung zum Zeitpunkt der Magen-Darm-Strongyliden(MDS)-Bekämpfung bei ökologisch gehaltenen Lämmern. Jahresber Bundesforschungsanst Landwirtsch Braunschweig Völkenrode 2002:165







