

Institut für
AK Agrarklimaschutz
Projekt
N2O-Isotopenfraktionierungsmethode

N2O-Isotopenfraktionierungsmethode zur Bestimmung von N2-Emissionen aus Böden – Entwicklung und Validierung
Denitrifikation ist eine sehr bedeutende Verlustgröße für reaktiven Stickstoff in Agrarböden. Sie kommt häufig vor, lässt sich kaum vorhersagen und ist bisher unter Feldbedingungen schwer messbar. Können Aussagen über N2-Emissionen durch Denitrifikation abgeleitet werden, wenn man Isotopensignaturen des Lachgases aus dem Boden bestimmt? Diese Frage behandeln wir in kontrollierten Prozessstudien im Labor und im Feld.
Hintergrund und Zielsetzung
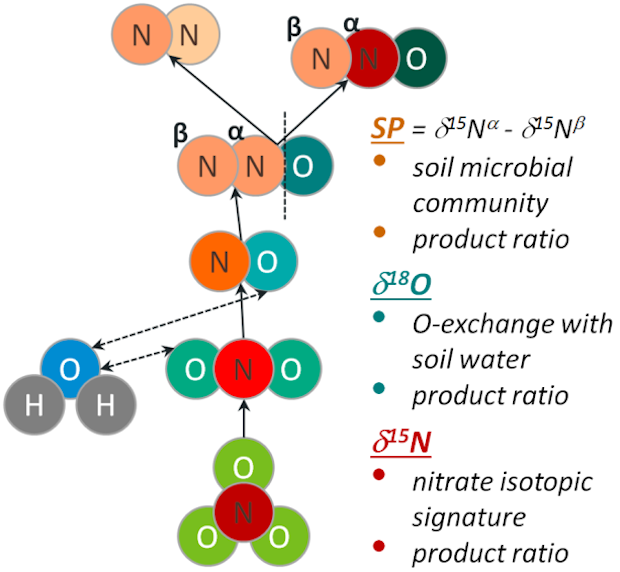
Die Denitrifikation vermindert einerseits den für Pflanzen verfügbaren Stickstoff (N) in Böden, sie ist andererseits ein wesentlicher Prozess für die Emission des klimarelevanten Gases N2O. Die Denitrifikation ist damit eine zentrale Größe im N-Haushalt insbesondere in gedüngten Agrarökosystemen, aber wegen methodischer Schwierigkeiten der Messung von N2-Emissionen in der Größenordnung ganzer Felder ist sie schwer zu bestimmen und daher unzureichend untersucht. Die Produktion und Reduktion von N2O durch Denitrifikation und die damit verbundenen Isotopeneffekte hinterlassen im N2O-Molekül eine spezifische Isotopensignatur. Sie setzt sich innerhalb des linearen N2O Moleküls aus der relativen An- oder Abreicherung von 15N und der schweren O-Isotopen (17O, 18O) sowie aus der Positions-spezifischen Verteilung von 15N zusammen. Die Isotopensignaturen in der N2O Signatur werden durch mehrere Faktoren beeinflusst: Die 15N und 17O/18O-Signaturen der Vorläuferverbindungen (Nitrat, Bodenwasser), den O-Austausch mit dem Bodenwasser bei der N2O-Produktion, die Raten der N2O-Produktion und der N2O-Reduktion zu N2 sowie die Isotopeneffekte (Fraktionierungsfaktoren) der verschiedenen Teilprozesse. Theoretisch lässt sich die N2O-Reduktion zu N2 – und damit die N2-Emission – aus der Isotopensignatur des emittierten N2O ableiten, wenn alle Parameter, die diese Signatur beeinflussen, ausreichend sicher bestimmbar sind. Ziel ist es, diesen methodischen Ansatz, d.h. die N2O-Isotopenfraktionierungsmethode zur Bestimmung von N2-Emissionen, im Labor zu prüfen.
Vorgehensweise
Wir prüfen die N2O-Isotopenfraktionierung anhand von Bodeninkubationen im Labor. In Inkubationsversuchen bestimmen wir zunächst einzelne oder mehrere Regelparameter direkt. Einige dieser Parameter werden erstmalig bestimmt (Isotopeneffekt des O-Austauschs mit H2O) oder erstmalig mit einer neuen Methode bestimmt (O-Austausch mit H2O anhand der 17O-Anomalie im produzierten N2O). Ein bestehendes Isotopenfraktionierungsmodell erweitern wir, um damit die Isotopensignatur von emittiertem N2O auf Basis der bestimmten Parameter zu simulieren und zu validieren. Schließlich inkubieren wir verschiedene Böden bei variierten Prozessbedingungen mit speziellen Methoden: Sie erlauben es, neben den Isotopensignaturen von N2O auch N2-Emission festzuhalten. Indem wir gemessene und mit dem Fraktionierungsmodell berechnete N2-Emissionen vergleichen, können wir prüfen, inwieweit die N2O-Fraktionierungsmethode sich für das Bestimmen von N2-Emissionen eignet und eine neue Option ist, die N2-Emissionen auf der Feldskala zu erfassen.
Unsere Forschungsfragen
- Ist die Isotopenfraktionierung während Denitrifikation stabil? Welche Faktoren regulieren die Größe der Isotopenfraktionierung?
- Welche Informationen liefern die Isotopensignaturen des Sauerstoffs im N2O und wie sind sie durch O-Austausch mit dem Bodenwasser beeinflusst?
- Kann man anhand von N2O-Isotopensignaturen die N2O Reduktion zu N2 quantifizieren? Welche Voraussetzungen müssen dafür gegeben sein und welche Genauigkeit kann erzielt werden?
- Ist die N2O-Isotopenfraktionierungsmethode in Feldstudien anwendbar?
Thünen-Ansprechperson

Thünen-Beteiligte
Beteiligte externe Thünen-Partner
- Georg-August-Universität Göttingen
(Göttingen, Deutschland)
Geldgeber
-
Deutsche Forschungsgemeinschaft (DFG)
(national, öffentlich)
Zeitraum
10.2011 - 3.2015
Weitere Projektdaten
Projektfördernummer: DFG We 1904/4-1
Projektstatus:
abgeschlossen
Publikationen
- 0
Jung M-Y, Gwak J-H, Rohe L, Giesemann A, Kim J-G, Well R, Madsen EL, Herbold CW, Wagner M, Rhee S-K (2019) Indications for enzymatic denitrification to N2O at low pH in an ammonia-oxidizing archaeon. ISME J 13:2633-2638, DOI:10.1038/s41396-019-0460-6
- 1
Lenhart K, Behrendt T, Greiner S, Steinkamp J, Well R, Giesemann A, Keppler F (2019) Nitrous oxide effluxes from plants as a potentially important source to the atmosphere. New Phytol 221(3):1398-1408, DOI:10.1111/nph.15455
- 2
Ostrom NE, Gandhi H, Coplen TB, Toyoda S, Böhlke JK, Brand WA, Casciotti KL, Dyckmans J, Giesemann A, Mohn J, Well R, Yu L, Yoshida N (2018) Preliminary assessment of stable nitrogen and oxygen isotopic composition of USGS51 and USGS52 nitrous oxide reference gases and perspectives on calibration needs. Rapid Comm Mass Spectrometry 32(15):1207-1214, DOI:10.1002/rcm.8157
- 3
Wu D, Senbayram M, Well R, Brüggemann N, Pfeiffer B, Loick N, Stempfhuber B, Dittert K, Bol R (2017) Nitrification inhibitors mitigate N2O emissions more effectively under straw-induced conditions favoring denitrification. Soil Biol Biochem 104:197-207, DOI:10.1016/j.soilbio.2016.10.022
- 4
Lewicka-Szczebak D, Augustin J, Giesemann A, Well R (2017) Quantifying N2O reduction to N2 based on N2O isotopocules - validation with independent methods (helium incubation and 15N gas flux method). Biogeosciences 14(3):711-732, DOI:10.5194/bg-14-711-2017
- 5
Schorpp Q, Riggers C, Lewicka-Szczebak D, Giesemann A, Well R, Schrader S (2016) Influence of Lumbricus terrestris and Folsomia candida on N2O formation pathways in two different soils - with particular focus on N2 emissions. Rapid Comm Mass Spectrometry 30(21):2301-2314, DOI:10.1002/rcm.7716
- 6
Lewicka-Szczebak D, Dyckmans J, Kaiser J, Marca A, Augustin J, Well R (2016) Oxygen isotope fractionation during N2O production by soil denitrificication. Biogeosciences 13(4):1129-1144, DOI:10.5194/bg-13-1129-2016
- 7
Dyckmans J, Lewicka-Szczebak D, Szwec Lars, Langel R, Well R (2015) Comparison of methods to determine triple oxygen isotope composition of N2O. Rapid Comm Mass Spectrometry 29(21):1991-1996, DOI:10.1002/rcm.7311
- 8
Lewicka-Szczebak D, Well R, Bol R, Gregory AS, Matthews GP, Misselbrook TH, Whalley WR, Cárdenas LM (2015) Isotope fractionation factors controlling isotopocule signatures of soil-emitted N2O produced by denitrification processes of various rates. Rapid Comm Mass Spectrometry 29:269-282, DOI:10.1002/rcm.7102
- 9
Mander Ü, Maddison M, Soosaar K, Koger H, Teemusk A, Truu J, Well R, Sebilo M (2015) The impact of a pulsing water table on wastewater purification and greenhouse gas emission in a horizontal subsurface flow constructed wetland. Ecol Eng 80(Spec. iss.):69-78, DOI:10.1016/j.ecoleng.2014.09.075
- 10
Huang T, Gao B, Hu X-K, Lu X, Well R, Christie P, Bakken LR, Ju X (2014) Ammonia-oxidation as an engine to generate nitrous oxide in an intensively managed calcarous Fluvo-aquic soil. Sci Rep 4:3950, DOI:10.1038/srep03950
- 11
Lewicka-Szczebak D, Well R, Köster JR, Fuß R, Senbayram M, Dittert K, Flessa H (2014) Experimental determinations of isotopic fractionation factors associated with N2O production and reduction during denitrification in soils. Geochim Cosmochim Acta 134:55-73, DOI:10.1016/j.gca.2014.03.010
- 12
Mohn J, Wolf B, Toyoda S, Lin C-T, Liang M-C, Brüggemann N, Wissel H, Steiker AE, Dyckmans J, Szwec Lars, Ostrom NE, Casciotti KL, Forbes M, Giesemann A, Well R, Doucett RR, Yarnes CT, Ridley AR, Kaiser J, Yoshida N (2014) Interlaboratory assessment of nitrous oxide isotopomer analysis by isotope ratio mass spectrometry and laser spectroscopy: current status and perspectives. Rapid Comm Mass Spectrometry 28:1995-2007, DOI:10.1002/rcm.6982
- 13
Mander Ü, Well R, Weymann D, Soosaar K, Maddison M, Kanal A, Lohmus K, Truu J, Augustin J, Tournebize J (2014) Isotopologue ratios of N2O and N2 measurements underpin the importance of denitrification in differently N-loaded riparian alder forests. Environ Sci Technol 48:11910-11918, doi:10.1021/es501727h
- 14
Lewicka-Szczebak D, Well R, Giesemann A, Rohe L, Wolf U (2013) An enhanced technique for automated determination of 15N signatures of N2, (N2+N2O) and N2O in gas samples. Rapid Comm Mass Spectrometry 27(13):1548-1558, DOI:10.1002/rcm.6605
- 15
Giesemann A, Lewicka-Szczebak D, Well R (2013) Automated analysis of 15N signatures of N2 (N2 + N2O) and N2O in gas samples - advances in measurement technique : [Abstract for] Cost-Sibae 2013 Meeting: Challenges in the Applications of Stable Isotopes across Disciplines and Scales, Wroclaw, Poland; 05/2013.
- 16
Lewicka-Szczebak D, Senbayram M, Köster JR, Well R (2013) Isotope fractionation factors of N2O production and reduction by denitrification: b. Modeling data from soil incubation under N2-free atmosphere. Geophys Res Abstr 15:8864
- 17
Well R, Weymann D, Lewicka-Szczebak D, Rohe L, Flessa H (2013) Isotope fractionations factors of N2O production and reduction by denitrification: a. Laboratory incubation studies using N2O reductase inhibition. Geophys Res Abstr 15:8210
- 18
Köster JR, Well R, Tuzson B, Bol R, Dittert K, Giesemann A, Emmenegger L, Manninen A, Cárdenas LM, Mohn J (2013) Novel laser spectroscopic technique for continuous analysis of N2O isotopomers - application and intercomparison with isotope ratio mass spectrometry. Rapid Comm Mass Spectrometry 27(1):216-222, DOI:10.1002/rcm.6434
- 19
Mukotaka A, Toyoda S, Yoshida N, Well R (2013) On-line triple oxygen isotope analysis of nitrous oxide using decomposition by microwave discharge. Rapid Comm Mass Spectrometry 27(21):2391-2398, DOI:10.1002/rcm.6698
- 20
Köster JR, Well R, Dittert K, Giesemann A, Lewicka-Szczebak D, Mühling KH, Herrmann A, Lammel J, Senbayram M (2013) Soil denitrification potential and its influence on N2O reduction and N2O isotopomer ratios. Rapid Comm Mass Spectrometry 27(21):2363-2373, DOI:10.1002/rcm.6699
- 21
Köster JR, Senbayram M, Dittert K, Well R, Giesemann A, Lewicka-Szczebak D, Mühling KH (2013) Soil denitrification potential and its influence on the N2O / N2 product ratio and N2O isotopomer ratios. Geophys Res Abstr 15:13171
- 22
Lewicka-Szczebak D, Senbayram M, Köster JR, Well R (2013) Stable isotopic signatures of N2O produced by denitrification: Experimental determination of fractionation factors : [Abstract for] Cost-Sibae 2013 Meeting: Challenges in the Applications of Stable Isotopes across Disciplines and Scales, Wroclaw, Poland; 05/2013.
- 23
Well R, Eschenbach W, Flessa H, Heide C von der, Weymann D (2012) Are dual isotope and isotopomer ratios of N2O useful indicators for N2O turnover during denitrification in nitrate-contaminated aquifers? Geochim Cosmochim Acta 90(1):265-282, DOI:10.1016/j.gca.2012.04.045






